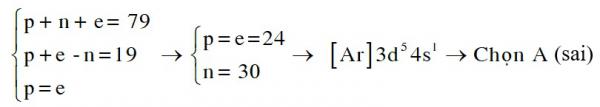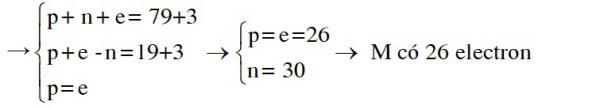Khoa Sư phạm
Trường Đại học Hà Tĩnh
a. Đặt vấn đề
Thực tế giảng dạy nhiều năm ở bậc trung học phổ thông, tôi nhận thấy học sinh gặp khá nhiều khó khăn khi học một số kiến thức ở những chương đầu của hóa học lớp 10. Một phần có lẽ vì mới bước vào một cấp học mới, phần khác là kiến thức của các chương về cấu tạo nguyên tử, bảng tuần hoàn các nguyên tố hóa học là mảng kiến thức trừu tượng, học sinh khó hình dung. Vì vậy, việc phân tích những lỗi sai các em thường gặp phải và sửa chữa những sai lầm đó là việc rất quan trọng, giúp học sinh nắm vững kiến thức của những chương đầu của lớp 10, tạo nền tảng tốt cho việc học tập môn Hóa học từ đó nâng cao chất lượng dạy học bộ môn Hóa học ở trường phổ thông.
b. Nội dung
1. Dạng bài tập viết cấu hình electron nguyên tử, ion
a. Viết cấu hình electron của nguyên tử
Đối với dạng bài tập này học sinh thường quên cách viết cấu hình electron của electron của các nguyên tử nguyên tố nhóm B. Cách viết đúng là:
Bước 1: Điền electron theo thứ tự mức năng lượng:
1s2s2p3s3p4s3d4p…
Bước 2: Sắp xếp lại cấu hình electron theo thứ tự lớp:
1s2s2p3s3p3d4s4p...
Ví dụ 1: Viết cấu hình electron nguyên tử Fe (Z = 26):
Cấu hình electron sai: 1s22s22p63s23p64s23d6
Cấu hình electron đúng: 1s22s22p63s23p63d64s2
Chú ý: 24Cr: 1s22s22p63s23p63d54s1
29Cu: 1s22s22p63s23p63d104s1
b. Viết cấu hình electron của ion từ cấu hình electron của nguyên tử tạo ion đó
Sai : Bớt electron lần lượt từ mức năng lượng cao xuống năng lượng thấp.
Đúng: Bớt electron lần lượt từ phân lớp ngoài cùng vào các phân lớp bên trong.
Ví dụ 2: + Viết cấu hình electron của ion Fe2+:
Sai: Bớt 2 electron ở phân lớp 3d6: 1s22s22p63s23p63d44s2
Đúng: Bớt 2 electron ở phân lớp 4s2: 1s22s22p63s23p63d6
+ Cấu hình electron của ion Fe3+:
Sai: Bớt 2 electron ở phân lớp 3d6: 1s22s22p63s23p63d34s2
Đúng: Bớt 2 electron ở phân lớp 4s2, 1 eletron ở phân lớp 3d6
→ 1s22s22p63s23p63d5
Ví dụ 3: Một ion M3+ có tổng số hạt proton, neutron, electron là 79, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 19. Cấu hình electron của nguyên tử M là:
- [Ar]3d54s1 B. [Ar]3d64s2 C. [Ar]4s23d6 D. [Ar]3d8
Lỗi sai học sinh thường gặp:
1. Nhầm lẫn số electron của ion M3+ bằng số electron của nguyên tử M, dẫn đến lập hệ phương trình:
2. Viết thứ tự năng lượng sau đó không viết lại cấu hình electron theo thứ tự lớp → cấu hình electron : [Ar]4s23d6 → Chọn C ( sai)
3. Vi phạm việc sắp xếp electron theo thứ tự năng lượng: 3d có mức năng lượng thấp hơn 4s → điền electron vào 3d trước → Cấu hình electron: [Ar]3d8 → Chọn D(sai)
Hướng dẫn giải:
Ion M3+ có: Tổng số hạt p, n, e là 79 → p+ n + (e− 3) = 79
Số hạt mang điện nhiều hơn số hạt không mang điện là 19 → p + (e − 3) – n =19
→ Cấu hình electron của M là [Ar]3d64s2
→ Đáp án B.
2. Dạng bài tập về hóa trị của nguyên tố
Học sinh thường bị nhầm lẫn trong việc lập công thức hóa trị cao nhất của nguyên tố với oxygen, hydrogen; Không biết mối liên hệ: hóa trị cao nhất của nguyên tố trong oxit + hóa trị của nguyên tố đó trong trường hợp chất khí với hydrogen = 8.
Nguyên tố M thuộc nhóm xA thì:
- Công thức hợp chất khí với H là: MH8-x ( x = 4 → 7)
- Công thức oxit cao nhất là: M2Ox ( x = 1 → 7)
Ví dụ 1: Nguyên tử của nguyên tố X có cấu hình electron lớp ngoài cùng là ns2np4. Trong hợp chất khí của nguyên tố X với hydrogen, X chiếm 94,12% khối lượng. Phần trăm khối lượng của nguyên tố X trong oxide cao nhât là:
- 50% B. 25% C. 60% D. 40%
Lỗi sai học sinh thường gặp:
→ Đáp án D.
Ví dụ 2: Công thức phân tử của hợp chất khí tạo bởi nguyên tố R và hydrogen là RH3. Trong oxide mà R có hóa trị cao nhất thì oxygen chiếm 74,07% về khối lượng. Nguyên tố R là:
- S B. As C. N D. P
Lỗi sai học sinh thường gặp:
 3. Dạng bài tập tìm nguyên tố ở nhóm, chu kì kế tiếp
3. Dạng bài tập tìm nguyên tố ở nhóm, chu kì kế tiếp
Học sinh cần nắm vững lý thuyết:
+ Sự chênh lệch số proton trong nguyên tử của X,
+ X và Y là hai nguyên tố thuộc cùng một chu kì, hai nhóm A liên tiếp
* Trường hợp 1: X, Y thuộc cùng một chu kì nhỏ 1, 2, 3: Py – Px =1
* Trường hợp 2: X, Y thuộc cùng một chu kì lớn 4, 5, 6, 7: Py – Px =11
+ Hai nguyên tố cùng nhóm A, thuộc hai chu kì kế tiếp
* Trường hợp 1: X thuộc cùng một chu kì nhỏ 1, 2: Py – Px =8
* Trường hợp 2: X, Y thuộc cùng một chu kì lớn 3, 4: Py – Px =18
Nhầm lẫn: Học sinh thường bỏ quên trường hợp thứ hai ở cả 2 dạng bài tập trên
Ví dụ 1: Hai nguyên tố X và Y cùng thuộc một chu kì trong bảng tuần hoàn các nguyên tố hóa học, X thuộc nhóm IIA, Y thuộc nhóm IIIA, (Zx + Zy = 51). Phát biểu nào sau đây đúng
- Kim loại X không khử được Cu2+ trong dung dịch.
- Hợp chất oxide của X có dạng X2O7.
- Trong nguyên tử nguyên tố X có 25 proton.
- Ở nhiệt độ thường X không khử được H2O.
Lỗi sai học sinh thường gặp:
- Nếu chỉ xét trường hợp 1 thì X là Mn, Y là Fe → Hợp chất với oxygen của X có dạng X2O7 → Chọn B
- Nếu chỉ xét trường hợp 1 thì Px = 25 → Chọn C
- Nếu chỉ xét trường hợp 1 thì : X là Mn (là kim loại hoạt động trung bình)
→ X không khử được nước → Chọn D
Hướng dẫn giải
TH1: Nếu X, Y thuộc chu kì 2, 3
→ Ca không khử được ion Cu2+ trong dung dịch.
→ Đáp án A
c. Kết luận
Từ một số ví dụ đã nêu trên tôi nhận thấy sự nhầm lẫn, sai sót của học sinh chủ yếu do không nắm vững lí thuyết chương Nguyên tử và Bảng tuần hoàn các nguyên tố hóa học. Việc chỉ ra những sai lầm đó giúp các em khắc sâu hơn lí thuyết đã học từ đó vận dụng lí thuyết một cách linh hoạt để giải đúng, giải nhanh bài tập hóa học chương I, chương II hóa học lớp 10.
TÀI LIỆU THAM KHẢO
[1]. Sách giáo khoa hóa học lớp 10.Bộ sách Cánh diều. NXB ĐH sư phạm.
[2]. Sách giáo khoa hóa học lớp 10. Bộ sách Kết nối tri thức và cuộc sống
[3]. Sách giáo khoa hóa học lớp 10. Bộ sách Chân trời sáng tạo.
[4]. Sách nâng cao hóa học 10, Nxb Giáo dục.
[5]. Đề thi THPT Quốc Gia.
Tin mới
- Lẩy Kiều - một dạng thức giao tiếp đặc biệt - 30/01/2026 11:10
- Yếu tố xác suất trong một số trò chơi - 17/01/2026 09:21
- Bồi dưỡng tâm hồn và cảm xúc thẩm mỹ cho học sinh Tiểu học qua môn mĩ thuật - 25/11/2025 15:38
- “Trăng sáng sân nhà em” - một bức tranh thôn quê trong trẻo và tinh nguyên - 04/11/2025 00:42
- Chuyển đổi số trong dạy học môn Âm nhạc ở các trường THCS trên địa bàn Thành phố Hà Tĩnh, tỉnh Hà Tĩnh - 22/07/2025 08:45
Các tin khác
- Tìm hiểu về cách thể hiện khái niệm số thập phân trong các bộ sách giáo khoa môn toán lớp 5 theo Chương trình Giáo dục phổ thông 2018 - 11/05/2025 14:37
- Phát huy tính tích cực, chủ động của học sinh trong dạy hát ở trường trung học cơ sở - 17/03/2025 14:08
- Truyện Kiều - Cuốn từ điển Bách khoa thư trong đời sống xã hội Việt Nam - 22/01/2025 13:01
- Hướng dẫn học sinh cân bằng nhanh phản ứng oxi hóa- khử theo phương pháp thăng bằng electron - 11/12/2024 13:49
- Đôi nét về “nhóm tứ kiệt” họa sĩ Việt Nam - 14/08/2024 15:39