Khoa Sư phạm
Trường Đại học Hà Tĩnh
Tóm tắt
Bài báo đề cập đến những cách vận dụng quy tắc octet trong quá trình hình thành liên kết hóa học các nguyên tố nhóm A được đề cập trong chương trình hóa học lớp 10 hiện nay, đồng thời giúp giải thích được sự hình thành liên kết trong một số chất.
Từ khóa: quy tắc octet; liên kết hóa học; giải thích.
Abstract
The article discusses ways to apply the octet rule in the process of forming chemical bonds with group A elements mentioned in the current 10th grade chemistry curriculum, and also helps explain bond formation in some substances.
Key words: Octet rule; a chemical connection; explain.
A. CƠ SỞ LÍ THUYẾT
1. Khái niệm liên kết hóa học
Liên kết hóa học là sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn. Trong các phản ứng hóa học, chỉ có các electron thuộc lớp ngoài cùng và phân lớp sát lớp ngoài cùng tham gia vào quá trình tạo thành liên kết.
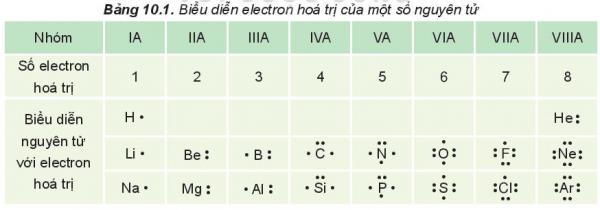
Các electron hóa trị của nguyên tử một nguyên tố được quy ước biểu diễn bằng các dấu chấm đặt xung quanh kí hiệu nguyên tố.
Biễu diễn electron hóa trị của một số nguyên tử
2. Quy tắc octet
Quy tắc octet: Trong phản ứng hóa học, các nguyên tử có xu hướng hình thành lớp vỏ bền vững như của khí hiếm.
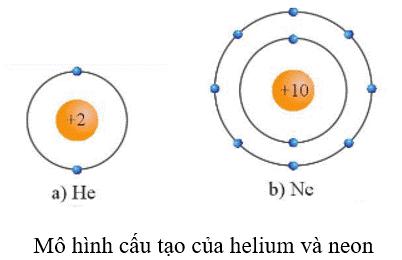
Các nguyên tử khí hiếm bền vững hơn rất nhiều so với các nguyên tử nguyên tố khác trong cùng chu kì nên rất khó tham gia các phản ứng hóa học. Điều này là do chúng có lớp electron ngoài cùng đã bão hòa với 8 electron (ngoại lệ là He với lớp electron ngoài cùng bão hòa 2 electron).
Các nguyên tử liên kết với nhau theo xu hướng chung là tạo ra lớp electron ngoài cùng như của khí hiếm để mỗi nguyên tử đó trở nên bền vững hơn.
B. NỘI DUNG
1. Vận dụng quy tắc octet trong quá trình hình thành liên kết hóa học của một số các nguyên tố nhóm A
Trong quá trình hình thành liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt được cấu hình bền vững như của khí hiếm với 8 electron ở lớp ngoài cùng (hoặc 2 electron ở lớp ngoài cùng như của helium).
Các phi kim với 5, 6 hoặc 7 electron ở lớp ngoài cùng có xu hướng nhận thêm electron để đạt 8 electron ở lớp ngoài cùng. Trong cùng chu kì, các nguyên tử có lớp ngoài cùng với 7 electron (các halogen) dễ nhận thêm electron hơn nên có tính phi kim mạnh nhất.
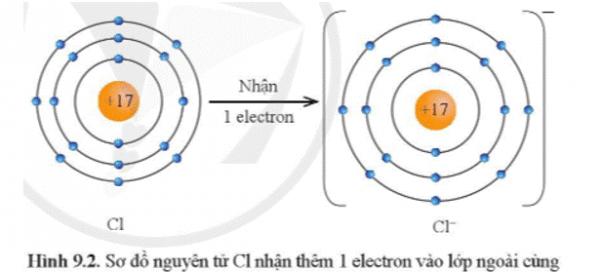
Ví dụ 1: Nguyên tử chlorine (Z = 17) có cấu hình electron là [Ne]3s23p5, có 7 electron ở lớp vỏ ngoài cùng.
Vậy xu hướng cơ bản của nguyên tử chlorine khi hình thành liên kết hóa học là nhận thêm 1 electron để đạt được lớp vỏ có 8 electron ở lớp ngoài cùng như của khí hiếm Ar (thay vì Cl phải nhường đi 7 electron để có lớp vỏ ngoài cùng là 2s22p6 – khó khăn hơn rất nhiều).
Sơ đồ nguyên tử Cl nhận thêm 1 electron vào lớp ngoài cùng
- Các kim loại có 1, 2 hoặc 3 electron ở lớp ngoài cùng có xu hướng nhường bớt toàn bộ các electron này để tạo thành ion dương tương ứng có 8 electron ở lớp ngoài cùng. Trong cùng chu kì, nguyên tử có 1 electron ở lớp ngoài cùng (các kim loại kiềm) dễ nhường electron hơn nên có tính kim loại mạnh nhất.
Ví dụ 2: Nguyên tử sodium (Z = 11) với cấu hình electron là [Ne]3s1, có 1 electron ở lớp vỏ ngoài cùng.
Vậy xu hướng cơ bản của nguyên tử sodium khi hình thành liên kết hóa học là nhường đi 1 electron để đạt được lớp vỏ có 8 electron ở lớp ngoài cùng như của khí hiếm Ne (thay vì sodium phải nhận thêm 7 electron để có lớp vỏ ngoài cùng là 3s23p6 – khó khăn hơn rất nhiều).
Ngoài cách các nguyên tử nhường và nhận electron để hình thành liên kết ion, quy tắc octet có thể đạt được bằng cách góp chung electron.
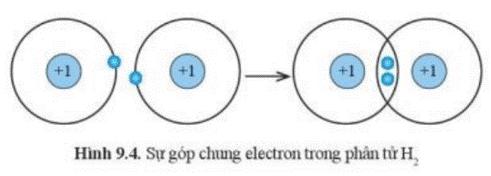
Ví dụ 3: Phân tử H2 được hình thành từ hai nguyên tử H bởi sự góp chung electron.
Sau khi hình thành liên kết, xung quanh mỗi nguyên tử H có một đôi electron chung, giống lớp vỏ bền vững của khí hiếm He.
Sự góp chung electron trong phân tử H2
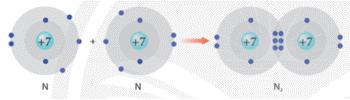
Ví dụ 4: Vận dụng quy tắc octet trong sự hình thành phân tử nitrogen (N2)
Liên kết giữa 2 nguyên tử nitrogen (N) trong phân tử nitrogen (N2) được tạo thành do mỗi nguyên tử N đã góp chung 3 electron hóa trị, tạo nên 3 cặp electron chung.
Phân tử N2 xung quanh mỗi nguyên tử N đều có 8 electron.
Ví dụ 5: Vận dụng quy tắc octet trong sự tạo thành phân tử NaF.
Nguyên tử sodium có 1 electron ở lớp ngoài cùng. Nếu mất đi 1 electron nguyên tử sodium sẽ tạo thành hạt mang điện dương, có cấu hình electron bền vững, giống với khí hiếm gần nhất là Ne.
Viết gọn: Na → Na+ + 1e
Nguyên tử fluorine có 7 electron ở lớp ngoài cùng. Khi nhận vào 1 electron nguyên tử fluorine sẽ tạo thành hạt mang điện âm, có cấu hình electron bền vững giống khí hiếm Ne.
Viết gọn: F + 1e → F-
Các hạt tạo thành Na+; F- có điện tích trái dấu hút nhau tạo nên phân tử NaF.
2. Một số bài tập tự luyện
Câu 1. Nguyên tử của các nguyên tố hydrogen và fluorine có xu hướng cho đi, nhận thêm hay góp chung các electron hóa trị khi tham gia liên kết hình thành phân tử hydrogen fluoride (HF)?
Câu 2. Ion sodium và ion fluoride có cấu hình electron của các khi hiếm tương ứng nào?
Câu 3. Trình bày sự hình thành ion lithium. Cho biết ion lithium có cấu hình electron của khí hiếm tương ứng nào?
Câu 4. Biết phân tử magnesium oxide hình thành bởi các ion Mg2+ và O2-. Vận dụng quy tắc octet, trình bày sự hình thành các ion trên từ những nguyên tử tương ứng?
Câu 5. Vận dụng quy tắc octet, trình bày sơ đồ mô tả sự hình thành phân tử potassium chloride (KCl) từ nguyên tử của các nguyên tố potassium và chlorine?
Câu 6. Nguyên tử nitrogen và nguyên tử aluminium (nhôm) có xu hướng nhận hay nhường lần lượt bao nhiêu electron để đạt được cấu hình bền vững
- Nhận 3 electron, nhường 3 electron.B. Nhận 3 electron, nhường 5 electron.
- Nhận 5 electron, nhường 5 electron.D. Nhận 5 electron, nhường 3 electron.
Câu 7. Khi hình thành liên kết hóa học, nguyên tử có số hiệu nào sau đây có xu hướng nhường 2 electron để đạt cấu hình electron bền vững theo quy tắc octet?
A. Z = 12. B. Z = 9. C. Z = 11. D. Z = 10.
Câu 8. Sodium hydride (NaH) là một hợp chất được sử dụng như một chất lưu trữ hydrogen trong các phương tiện chạy bằng pin nhiên liệu do khả năng giải phóng hydrogen của nó. Trong sodium hydride nguyên tử sodium có cấu hình bền của khí hiếm
- helium. B. argon. C. krypton. D. neon.
Câu 9. Khi tham gia hình thành liên kết hóa học, các nguyên tử lithium và chlorine có khuynh hướng đạt cấu hình electron bền của lần lượt các khí hiếm nào dưới đây?
- Helium và argon. B. Helium và neon.
- Argon và helium. D. Neon và argon.
Câu 10. Trong phân tử HBr, nguyên tử hydrogen và bromine đã lần lượt đạt cấu hình electron bền của các khí hiếm nào dưới đây?
- Helium và xenon. B. Helium và radon.
- Helium và krypton. D. Neon và argon.
Câu 11. Cho các ion: Ca2+, F– , Al3+ và N3–. Số ion có cấu hình electron của khí hiếm neon là
- 4B. 2 C. 1 D. 3
Câu 12. Nguyên tử của nguyên tố nào sau đây có xu hướng đạt cấu hình electron bền vững của khí hiếm neon khi tham gia hình thành liên kết hoá học?
- Sulfur.B. Oxygen. C. Hydrogen. D. Chlorine.
Câu 13. Nguyên tử của nguyên tố nào sau đây có xu hướng đạt cấu hình electron bền vững của khí hiếm argon khi tham gia hình thành liên kết hoá học?
- Fluorine.B. Oxygen. C. Hydrogen. D. Chlorine.
Câu 14. Trong phân tử iodine (I2), mỗi nguyên tử iodine đã góp một electron để tạo cặp electron chung. Mỗi nguyên tử iodine đã đạt cấu hình electron bền vững của khí hiếm nào dưới đây?
- Xe.B. Ne. C. Ar. D. Kr.
Câu 15. Trong các hợp chất, nguyên tử magnesium đã đạt được cấu hình bền của khí hiếm gần nhất bằng cách
A. cho đi 2e. B. nhận vào 1e. C. cho đi 3e. D. nhận vào 2e.
C. KẾT LUẬN
Trên đây là một số cách vận dụng quy tắc octet trong quá trình hình thành liên kết hóa học của một số các nguyên tố nhóm A được đề cập trong chương trình hóa học lớp 10 hiện nay, đồng thời giúp giải thích được sự hình thành liên kết trong một số chất.
Với việc áp dụng các kiến thức trên trong thực tế giảng dạy chúng tôi thấy khả năng giải bài tập của học sinh đã được nâng cao, các em không còn ngại hay sợ sệt khi gặp các bài tập về phần này.
TÀI LIỆU THAM KHẢO
[1]. Sách giáo khoa hóa học lớp 10 (cánh diều), Nxb ĐH Sư phạm.
[2]. Sách giáo khoa hóa học lớp 10 (kết nối tri thức vào cuộc sống). Nxb Giáo dục
[3]. Sách giáo khoa hóa học lớp 10 ( chân trời sáng tạo). Nxb Giáo dục
[4]. Sách bài tập hóa học 10.
Tin mới
- Thủ pháp soạn câu intro, inter luck và câu ending cho bài hát mầm non trên đàn phím điện tử - 16/08/2025 00:05
- Về các phép tính với phân số trong các bộ Sách giáo khoa môn Toán lớp 4 theo Chương trình giáo dục phổ thông 2018 - 12/01/2025 00:28
- Cây cam ngọt của tôi – những triết lí về cuộc sống (José Mauro de Vasconcelos) - 09/08/2024 16:41
- Thành ngữ Hán - Việt trong văn chính luận của Chủ tịch Hồ Chí Minh - 15/07/2024 08:31
- Vai trò của giáo viên Âm nhạc theo Chương trình Giáo dục phổ thông 2018 - 03/05/2024 04:23
Các tin khác
- Xây dựng môi trường giáo dục đổi mới, tích cực, sáng tạo – yếu tố thúc đẩy sự thích ứng nghề nghiệp của giáo viên mầm non - 13/10/2023 01:05
- Một số trò chơi học tập để luyện phát âm cho trẻ mẫu giáo - 04/10/2023 03:12
- Đặc điểm nổi bật của thơ truyện viết cho trẻ lứa tuổi mầm non - 10/09/2023 13:13
- Suy cảm về nghệ thuật (hội họa) trừu tượng - 27/08/2023 04:59
- Sử dụng phương pháp quy đổi để giải nhanh bài tập trắc nghiệm hóa học - 24/07/2023 03:42